王 婧(1988-), 女, 硕士研究生. E-mail:jw881010@163.com
通过两种不同多孔结构的双相磷酸钙(biphasic calcium phosphate, BCP)陶瓷的制备, 以人血清为蛋白溶液模型, 选择三种不同的洗脱液对材料表面吸附的血清蛋白进行洗脱, 考察不同洗脱液及材料多孔结构对于BCP陶瓷表面吸附血清蛋白洗脱效果的影响。结果显示, 相对于2 mol/L氯化钠(NaCl)和 2%十二烷基磺酸钠溶液, 400 mmol/L 磷酸钠(Na3PO4)溶液对于BCP陶瓷表面吸附的血清蛋白洗脱效果更佳。此外, 材料多孔结构在血清蛋白的吸附和洗脱中起重要作用, 微孔结构能促进BCP陶瓷表面的血清蛋白吸附并减缓吸附蛋白的释放速率, 而三维贯通的大孔结构则有利于材料表面吸附血清蛋白的洗脱和释放。
Two types of porous BCP ceramics were fabricated, using human serum as the model of protein solution. The effect of the different eluants and porous structure on the elution of the adsorbed serum proteins on BCP ceramics were investigated. The results showed that 400 mmol/L Na3PO4 solution had higher elution efficiency for the adsorbed serum proteins on BCP ceramics than 2 mol/L NaCl or 2% sodium dodecycl sufonate (SDS) solution. Moreover, the porous structure of BCP ceramics had a strong impact on the elution of the adsorbed serum proteins. The microporous structure could promote the adsorption of serum proteins on BCP ceramics and slowed down their release rate, but the 3D interconnected macropores were favorable for the elution and release of serum proteins from the BCP surface.
磷酸钙陶瓷的骨诱导性自上世纪90年代以来被广泛报道和证实[ 1, 2, 3], 但是有关其机理仍不十分清楚。通常而言, 蛋白吸附是生物材料体内植入后的初始事件, 并将影响随后的细胞及组织生长[ 4, 5]。因此, 生物材料的蛋白吸附特性对于其生物相容性和生物活性至关重要, 并直接影响其最终生物学性能。
尽管人们对于磷酸钙陶瓷的蛋白吸附特性作了大量的研究, 但大多局限于单蛋白或简单的混合体系[ 6, 7, 8, 9, 10], 与生理复杂环境缺乏直接关联。由于与植入体作用的血液和其它组织液均含有成百上千种蛋白质, 这些不同种类及性质的蛋白质在材料表面是一个复杂的动态竞争吸附过程, 所以定性定量分析材料表面蛋白吸附层的组成和结构对于揭示磷酸钙陶瓷骨诱导机理具有十分重要的意义。
尽管目前有很多方法可以用于研究材料的蛋白吸附特性, 但对于生理环境下的复杂多蛋白体系而言, 计算机辅助双相电泳系统(two-dimensional electrophoresis, 2-DE)是一种很有效的方法。近年来, 该系统已被应用于生物陶瓷、金属以及高分子等生物材料的蛋白吸附研究[ 11, 12, 13, 14]。但是, 要精确地表征材料表面吸附的蛋白, 必须首先将其完整地洗脱下来再进行分析, 因此洗脱的效率十分关键。SDS溶液是目前生物材料研究中最常用的蛋白洗脱液之一[ 11, 15, 16], 但是其对于磷酸钙陶瓷表面吸附蛋白的洗脱效果还需进一步确认。迄今为止, 很少有人研究材料多孔结构对其表面吸附蛋白洗脱效果的影响。因此, 本研究选择具有优良骨诱导性的不同孔结构BCP陶瓷和人血清为材料和蛋白溶液模型, 考察不同洗脱液以及材料本身多孔结构对于材料表面吸附蛋白洗脱效果的影响。
BCP前驱粉体(HA/β-TCP≈60/40, 粒径~120 μm目以下)由四川大学生物材料工程研究中心提供。本实验制备两种不同多孔结构的BCP陶瓷, 具体方法如下: 将BCP前驱粉体与适量的30wt%双氧水(H2O2)、40wt%聚乙烯醇6000及3wt%甲基纤维素溶液均匀混合, 置于微波炉中微波辅助加热发泡后高速搅拌使气泡均匀化, 然后将浆料注入吸水性模具中成型, 40℃烘干后置于马弗炉(LH 15/14, Nabertherm, Germany)中1100℃高温烧结2 h, 得到三维贯通的兼有大孔及微孔的BCP1陶瓷; 微孔型BCP2陶瓷的制备与上述方法类似, 只是浆料准备中不添加H2O2发泡, 得到的浆料混匀后直接注入模具中烘干并烧结。将烧结后的陶瓷块切割成圆片(φ15 mm×2 mm), 去离子水超声清洗烘干后备用。
NaCl、Na3PO4及SDS等试剂均为分析纯, 购自于国内生产厂商; 人血清购自于北京元亨, BCA试剂盒(BCATM Protein Assay Kit)购自于美国Pierce公司。
采用扫描电镜(SEM, JSM-5900 OL, Jeol, Japan)分析BCP陶瓷的表面形貌和微观结构; 采用全自动压汞仪(AutoPore IV 9500, Micromeritics, USA)分析BCP陶瓷的孔隙率、孔体积以及孔尺寸分布特性。
实验用蛋白溶液为人血清, 蛋白吸附实验在24孔培养板中进行, 具体为: 在培养板的每个孔中放材料样品, 加入1 mL人血清后置于摇床上37℃振荡孵育2 h, 然后吸去孔内的蛋白溶液, 再用去离子水清洗5次以去除材料表面未牢固结合的蛋白质, 最后得到吸附有血清蛋白的陶瓷片。
由于磷酸钙陶瓷表面的蛋白吸附受溶液中离子强度和成分影响较大[ 17], 因此除常规的2% SDS外, 实验还选择2 mol/L NaCl和400 mmol/L Na3PO4溶液对材料表面吸附的蛋白进行洗脱, 并对它们的洗脱效率进行比较。将洗脱液(300 μL/孔)加入到装有吸附血清蛋白陶瓷片的培养板中, 摇床上37℃振荡孵育不同时间后收集样品, 考察洗脱液成分和脱附时间对材料表面血清蛋白洗脱的影响; 另外, 为考察多孔结构对血清蛋白洗脱的影响, 用400 mmol/L Na3PO4溶液对两种BCP陶瓷吸附的血清蛋白进行洗脱, 每间隔2 h收集洗脱样品并重新更换新的洗脱液再洗脱, 如此重复4次并收集相应洗脱样品。
收集的样品溶液采用BCA法进行蛋白定量分析, 取25 μL样品和200 μLBCA工作试剂加入到96孔培养板中, 混匀后在37℃烘箱中孵育30 min后置于全波长扫描式多功能读数仪(Varioskan Flash, Thermo Scientific, USA)中测量570 nm波长下的吸光度值, 再根据标准曲线计算出样品中的总血清蛋白含量。
图1为两种BCP陶瓷的SEM照片。从图1(a)和(b)的低倍照片可以看出两种BCP陶瓷在宏观结构上具有明显的差异, BCP1表面有数量众多的尺寸在100~500 μm的大孔, 大部分大孔的孔壁上存在10~100 μm之间的孔使得大孔之间相互贯通, 而BCP2表面相对平整, 仅有个别大孔存在; 但是从图1(c)和(d)的高倍照片可以发现, 这两种陶瓷在微观结构上没有明显差异, 陶瓷晶粒间遍布着纳米及亚微米级的微孔。
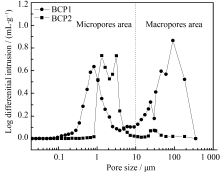
表1和图2为两种BCP陶瓷的全自动压汞仪分析结果。从表1中可以看出, 由于BCP1具有丰富的大孔结构, 其平均孔径更大, 也导致其比BCP2具有更高的孔隙率和总孔体积。但是, 从图2的孔尺寸分布图中可以发现, 两种BCP陶瓷均具有丰富的微孔, 该结果也与前面的SEM观察相一致。另外, BCP1微孔尺寸稍小一些, 但是BCP2的微孔体积更大。
| 表1 两种BCP陶瓷的孔结构参数 Table 1 Analysis for porous structure of BCP ceramics |
分别用2 mol/L NaCl、400 mmol/L Na3PO4、2% SDS溶液对两种BCP陶瓷表面吸附的血清蛋白进行洗脱, 其洗脱时间对于蛋白洗脱效果的影响如图3所示。对比图3(a)和(b)可以看出, 两种不同多孔结构BCP陶瓷表面吸附血清蛋白的洗脱都遵循同样的规律。无论使用哪一种洗脱液, 随洗脱时间的延长, 洗脱液中的血清蛋白浓度均逐渐增加, 但当洗脱时间达到2 h后, 洗脱液中的血清蛋白浓度不再有明显的增加, 说明此时已达到其最大洗脱能力。另外, 比较这三种洗脱液中的最大血清蛋白浓度值, 可以清楚地知道它们对于BCP陶瓷表面吸附的血清蛋白具有不同的洗脱能力, 其顺序依次是400 mmol/L Na3PO4 > 2% SDS > 2 mol/L NaCl。
 | 图3 两种不同多孔结构BCP陶瓷表面吸附血清蛋白的洗脱随洗脱液成分和洗脱时间的变化Fig. 3 Effect of eluting time on the elution efficiency of different eluants for serum proteins adsorbed on BCP1 (a) and BCP2 (b) ceramics |
材料表面的蛋白吸附决定于它们之间的相互作用, 包括静电力、疏水相互作用、范德华力、氢键作用力等[ 4]。因此, 要洗脱材料表面吸附的蛋白, 必须克服和破坏这些相互作用。前期的研究证实磷酸钙陶瓷在水溶液中通常具有负的表面电荷, 其表面吸附蛋白主要由静电和疏水相互作用控制[ 10]。由于SDS是一种阴离子表面活性剂, 能够破坏蛋白原有结构并与之形成带负电的络合物, 从而与材料表面产生静电排斥而导致蛋白的脱附[ 18]。一般来说, 磷酸钙陶瓷通过表面带正电的Ca2+位点(C-sites)和带负电的PO43-位点(P-sites)与蛋白表面带电基团相互作用[ 19]。因此, 可以通过改变溶液中的离子成分和强度产生离子交换作用来洗脱材料表面吸附的蛋白。前期的研究证实溶液的pH值、磷酸根离子(PO43-)以及离子强度显著影响磷酸钙陶瓷表面的蛋白吸附, 高浓度的PO43-和NaCl急剧降低蛋白吸附量[ 17]。因此, 本实验选择了2 mol/L NaCl和400 mmol/L Na3PO4溶液来洗脱BCP陶瓷表面吸附的血清蛋白, 与2% SDS溶液的洗脱效果相比较, 证实400 mmol/L Na3PO4溶液具有最高的血清蛋白洗脱能力, 这也说明BCP陶瓷表面C-sites在蛋白吸附中起主要作用。另外, 由于血清中蛋白种类众多, 且结构和性质有较大的差异, 因而与SDS结合能力也不同, 这可能是导致2% SDS不能完全洗脱BCP陶瓷表面吸附血清蛋白的重要因素。
用400 mmol/L Na3PO4溶液对两种不同多孔结构BCP陶瓷表面吸附的血清蛋白进行多次洗脱, 结果如图4所示。从图4(a)可以看出, 尽管400 mmol/L Na3PO4溶液对于BCP陶瓷表面吸附的血清蛋白具有很好的洗脱效果, 但也不能一次洗脱完材料表面吸附的血清蛋白, 只是随洗脱次数的增加, 停留在材料表面的蛋白量逐渐减少直至最后全部洗脱。另外值得注意的是, 根据血清蛋白洗脱量随洗脱次数的变化可以看出, 相对于BCP2而言, BCP1表面吸附的血清蛋白更容易被洗脱而释放出来。在进行第4次洗脱时, BCP2上还有较多的血清蛋白, 而BCP1上已接近于零。图4(b)显示的是血清蛋白累计洗脱量随洗脱次数的变化, 从中可以发现, BCP2比BCP1能吸附更多的血清蛋白, 说明BCP多孔结构的差异不仅影响其表面吸附血清蛋白的洗脱和释放, 还直接影响其蛋白吸附能力。
前期的研究已经证实, 材料的微孔结构对其蛋白吸附能力有较大的影响[ 9, 20]。从前面的材料表征可以知道, 尽管BCP1具有更高的孔隙率和总孔体积, 但是BCP2却有更大体积的微孔, 导致其能吸附更多的血清蛋白。另一方面, 由于BCP陶瓷表面具有丰富的微孔, 对蛋白脱附产生一定的空间位阻效应, 导致无法一次洗脱材料表面吸附的所有血清蛋白。但是, BCP1三维贯通的大孔结构有利于洗脱液进入材料内部孔隙并与其表面吸附的蛋白作用, 导致其表面吸附的血清蛋白能被快速洗脱和释放出来。
BCP陶瓷表面吸附血清蛋白的洗脱受多种因素影响, 不同成分的洗脱液显示不同的洗脱能力, 其顺序依次是400 mmol/L Na3PO4 > 2% SDS > 2 mol/L NaCl。另外, 材料的大孔和微孔结构在血清蛋白的吸附和洗脱中起重要作用, 具有更大微孔体积的BCP2比BCP1能吸附更多的血清蛋白, 但具有三维贯通大孔结构的BCP1则有利于其表面吸附血清蛋白的洗脱和释放。
本研究证实了影响磷酸钙陶瓷表面吸附血清蛋白洗脱的一些重要因素, 对于后续深入研究其体外和体内蛋白吸附特性, 进而探讨其骨诱导机理具有重要的意义。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|