王 坤(1987-), 男, 博士研究生. E-mail:wangkun_neu@yahoo.cn
在STA409PC热重分析仪上对Cu/Si氧载体的脱氧-吸氧性能加以研究, 并利用BET、SEM和XRD对所制备氧载体的比表面积、表面形貌和物相组成进行分析。结果表明, 在N2氛围中, 当温度高于850 ℃时Cu/Si氧载体脱氧反应进入快速反应阶段; 氧载体在空气氛围中再生的快速反应温度高于400 ℃; 氧载体脱氧和吸氧的反应速率随颗粒直径的减小及气体流量的增大, 而增大但变化不明显, 而随反应温度的升高, 氧载体脱氧和吸氧反应速率都会急剧增大; 23次循环实验中, 氧载体脱氧-吸氧性能稳定, 经循环之后的氧载体, 颗粒表面变得光滑, 空隙率增加, 但机械强度降低。物相分析结果表明氧载体脱氧后的成分主要有Cu2O和SiO2, 吸氧后的成分主要有CuO和SiO2, 氧载体的制备方法和循环性能有很好的稳定性和适应性。
The optimal reaction temperatures were investigated
化学链制氧(chemical looping oxygen production, CLOP)是一种新颖的制氧技术, 具有能耗低、成本低、操作简单等优点, 其能耗仅为0.08 kWh/m3, 是现有最先进低温精馏制氧能耗的26%[ 1]。适用于CLOP的氧载体的选取和性能研究是关键[ 2]。用于CLOP的氧载体必须具备在适合的温度和氧分压下脱氧和吸氧能力, 并且需要具有较高的氧传递能力、反应速率、机械强度、抗烧结能力、化学稳定性以及较低的成本和环境友好性[ 3]。研究发现, 金属氧化物CuO、Mn2O3、Co3O4及钙钛矿型氧化物CaMn0.875Ti0.125O3具有脱氧-吸氧能力[ 4, 5, 6, 7, 8], 其中CuO具有最大的氧传递能力(0.1 g/g CuO、0.03 g/g Mn2O3、0.06 g/g Co3O4以及0.08~0.09 g/g CaMn0.875Ti0.125O3)。但是铜的氧化物熔点低(CuO 熔点1450 ℃, Cu2O 熔点1235 ℃, CuO-Cu2O 共熔点1075 ℃), 使得CuO单独使用时极易发生烧结[ 9, 10]。添加惰性载体, 并利用适当的方法制备成氧载体可以提高铜氧化物的抗烧结能力[ 11, 12]。
目前文献中关于化学链制氧中氧载体的研究较少, Moghtaderi利用YSZ、Al2O3和TiO2作为惰性载体对铜基氧载体在不同温度下的脱氧性能进行了初步的探索[ 1]。SiO2是一种常见的惰性载体并广泛用于化学链燃烧技术中氧载体的制备[ 13, 14, 15, 16]。本工作采用机械混合法制备了Cu/Si氧载体, 对其脱氧-吸氧性能、循环稳定性及反应前后的表面形貌、物相组成进行了研究。
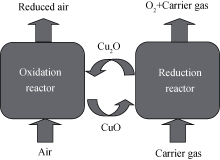
化学链制氧技术是基于化学链燃烧的思想提出的, 基本原理如图1所示。
CLOP过程分两步进行, 在脱氧反应器中氧载体发生脱氧反应生成氧气, 生成的氧气由通入的载气带出, 反应如式(1)所示: 4CuO→2Cu2O+O2, △ H850℃=263.2 kJ/mol O2 (1)
用于脱氧反应器中的载气一方面起到降低反应器中氧气浓度的作用; 另一方面起到将氧载体释放出来的氧气带出反应器的作用。载气的种类可以是水蒸气、纯氧、氮气及富含二氧化碳工业烟气等。
2Cu2O+O2→4CuO, △ H850℃=-263.2 kJ/mol O2 (2)
氧载体是连接两个反应器的纽带, 通过氧载体的循环使用, 实现化学链制取氧气的工艺。该工艺的特点在于: (1)化学链制氧可生产高纯度氧气(氧气理论纯度可达100%), 并可以在氧气稀薄的环境中快速制备高纯度氧气, 满足各行业对氧气的需求; (2)除了生产高纯氧, 还可根据用户对氧浓度的需求, 调整脱氧反应器载气的种类和流量, 制备不同浓度的氧气-载气合成气; (3)氧气的生产规模可控, 根据用户氧气需求量的大小, 可设计具有不同氧气生产规模的制氧系统; (4)能进行间歇生产和连续生产, 这可有效减少企业氧气的放散。
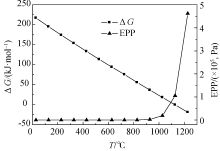
判断一种物质是否具有在适合的温度和氧分压下脱氧和吸氧的热力学性质, 则需要计算该物质脱氧或吸氧反应的吉布斯自由能变(Δ G)及平衡氧分压(EPP), Δ G和EPP可以通过下式计算:
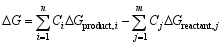 | (3) |
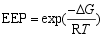 | (4) |
式中: Δ G 为氧载体制氧反应的吉布斯自由能变, J/mol; EPP为反应的平衡氧分压, Pa; T 为反应温度, ℃。
计算CuO脱氧反应的Δ G及EPP如图2所示。从图2可以看出反应的Δ G和EPP受温度影响很大, 随着反应温度升高, 反应的吉布斯自由能逐渐降低, 并出现Δ G<0。Δ G<0意味着不需要外界能量输入脱氧反应能自发进行。随着反应温度升高, 反应的平衡氧分压也逐渐增大, 意味着脱氧反应即使在较大的氧分压下也能发生。1027 ℃时, 反应的平衡氧分压为2.12×104Pa, 即在空气氛围中反应温度必须高于1027 ℃时, 氧化铜脱氧反应才能发生; 同理, 空气反应器中需要控制反应温度低于1027 ℃。
将一定粒径的CuO、SiO2粉末以6/4的质量比并加入质量分数为10%的石墨作为添加剂在玛瑙研钵中充分混合, 之后加入适量的去离子水使之成为具有适当粘度的糊状物, 然后压制成型, 置于温度为105 ℃的干燥箱中过夜干燥, 之后置于马弗炉中, 在950 ℃的温度下烧结6 h, 最后通过破碎和筛分分别获得粒径为76~125, 125~200 与200~315 μm的氧载体颗粒[ 17]。利用荷兰Panalytieal公司的PW- 3040/60型X射线衍射仪(XRD, CuKα)分析了制备好氧载体的物相组成; 利用日本Superscan公司的SSX-550型扫描电镜(SEM)观察其表面形貌; 利用美国Micromeritics公司的ASAP-2020型比表面积分析仪(BET)测试了其比表面积。表1给出了粒径为200~315 μm新制备的氧载体的性质, 所制备的氧载体主要由CuO和SiO2组成, 没有形成Cu-Si的化合物而影响其脱氧-吸氧性能, 说明了制备方法的可行性。所制备的氧载体有相对较大的机械强度, 根据Arjmand等[ 12]的研究, 机械强度小于1N的氧载体不适用于化学链燃烧系统, 可以通过增长烧结时间或提高烧结温度的方法来提高所制备氧载体的机械强度。
| 表1 氧载体的性质 Table 1 Oxygen carrier properties |
在STA409PC热重分析仪上对Cu/Si氧载体的脱氧和吸氧性能进行研究, 氮气作为氧载体脱氧时的载气, 而氧载体的再生是在空气氛围下进行的。实验采用了程序升温热重和等温热重两种方法, 首先以程序升温热重法找到氧载体脱氧和吸氧反应的快速反应温度阶段; 然后采用等温热重法研究了气体流量、反应温度、颗粒直径对氧载体性能的影响以及循环实验过程中氧载体的稳定性。为了减小反应气体由颗粒外表面向内部扩散的阻力, 将少量样品(10~16 mg)均匀平铺于石英坩锅底面。在程序升温热重实验中, 升温速率设为10 ℃/min。在等温热重实验中, 依据程序升温实验的实验结果, 氧载体脱氧反应的温度选为900 ℃、950 ℃和1000 ℃, 吸氧反应的温度选为600 ℃、650 ℃和700 ℃。循环实验中, 氧载体在900 ℃下发生脱氧反应, 反应时间为18 min, 在700 ℃下发生吸氧反应, 反应时间为12 min, 反应循环23次, 之后采用SEM和XRD对反应前后氧载体的表面形貌和物相组成加以分析。
综合热分析仪自动记录实验数据, 得到 m-θ(温度)或 m- t (时间) 曲线, 利用式(5)和(6)计算氧载体的转化率:氧载体脱氧反应转化率:
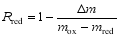 | (5) |
氧载体吸氧反应转化率:
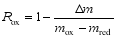 | (6) |
式中: Δ m为氧载体反应过程中质量变化, mg; mox 为氧载体充分氧化的质量, mg; mred 为氧载体完全脱氧后的质量, mg。
将氧载体转化率对相应的气化反应时间 t求一阶微分, 可以得到反应的反应速率 K。
采用程序升温法对氧载体脱氧-吸氧性能加以研究,找到脱氧和吸氧反应的快速反应的温度区间。图3示出了颗粒直径为125~200 μm氧载体的脱氧和吸氧反应的重量变化和变化速率曲线, 由图可知, 随着反应温度的升高, 氧载体脱氧和吸氧反应的速率都出现先增大后减小的趋势, 脱氧反应的反应温度为893 ℃时, 脱氧速率达到最大值, 氧化反应的反应温度为546 ℃时, 吸氧速率达到最大值; 脱氧反应和吸氧反应都存在快速反应阶段, 脱氧反应温度区间为850~950 ℃, 吸氧反应温度区间为400~650 ℃。
4.2.1 气体流量的影响
图4示出了脱氧反应温度为900 ℃, 吸氧反应温度为700 ℃, 氧载体颗粒直径为200~315 μm时, 其脱氧和吸氧反应的转化率随气体流量的变化曲线。由图4可知, 随着气体流量的增加, 氧载体脱氧反应和吸氧反应达到完全转化所用的时间不断减小, 说明高气体流量有利于氧载体脱氧反应和吸氧反应的进行。这是因为在脱氧反应中, 高的氮气流量可以将氧载体释放的氧气及时快速带出反应器, 使反应器内具有较低的氧气浓度, 而较低的氧浓度有利于脱氧反应的进行; 同理在氧化反应中, 高空气流量使得反应器内氧气浓度愈加稳定, 有利于氧化反应的进行。
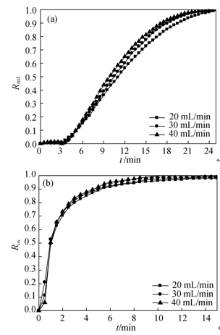 | 图4 不同流量下氧载体转化率随时间的变化Fig. 4 Changes of conversion ratio for oxygen carrier with time at different gas flow rates(a) Reduction; (b) Oxidation |
在有气体参与的化学反应中, 气体的平衡分压将对反应速率产生较大影响[ 4, 18]。比较图4 (a)和(b)可知, 气体流量对吸氧反应的影响要小于对脱氧反应的影响, 这是因为900 ℃时, 反应体系的平衡氧浓度为1.4%, 氧载体释放的氧气需由载气迅速带出以保证反应的进行; 而700 ℃时, 反应体系的平衡氧浓度为0.017%, 远远小于空气中的氧浓度, 吸氧反应的驱动力足够大, 可以保证脱氧反应的快速进行。
4.2.2 颗粒直径的影响
图5示出了脱氧反应温度为900 ℃, 吸氧反应温度为650 ℃, 气体流量为30 mL/min时, 不同颗粒直径氧载体脱氧和吸氧反应的转化率随时间的变化曲线。由图5可知, 随着颗粒直径的减小, 氧载体脱氧和吸氧反应的反应速率都逐步增大, 这是因为颗粒直径较小, 具有相对较大的比表面积, 加热速率快, 单颗粒径向温差较低, 更容易达到反应所需的温度; 但是颗粒直径过小, 颗粒之间的孔隙将会减小, 而空隙较小又不利于热量的传递。以上两个原因的共同作用下,导致反应速率受颗粒直径的影响不明显。
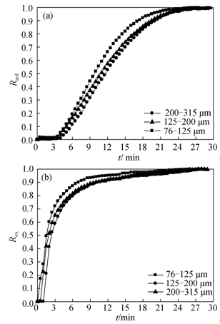 | 图5 不同颗粒直径的氧载体转化率随时间的变化Fig. 5 Changes of conversion ratio with time for oxygen carrier with different particle sizes(a) Reduction; (b) Oxidation |
4.2.3 反应温度的影响
图6示出了气体流量为30 mL/min时, 不同反应温度下粒径为200~315 μm的氧载体脱氧和吸氧反应转化率随时间的变化曲线。由图6可知, 随着反应温度的升高, 氧载体脱氧和吸氧反应的反应速率都逐步增大, 且变化趋势很明显, 说明在高温下, 氧载体具有更高的反应活性[ 18, 19]。这是因为温度的升高, 反应体系的平衡氧浓度逐渐增大(900 ℃为1.4%, 950 ℃为4.2%, 1000 ℃为11.4%), 平衡氧浓度越大, 脱氧反应的驱动力越大, 反应速度逐步增大; 而吸氧反应在600 ℃、650 ℃和700 ℃下进行, 此时反应体系的平衡氧浓度均低于0.02%, 空气中氧浓度远远大于平衡氧浓度, 致使温度的影响较脱氧反应相对较小。
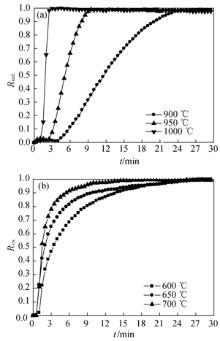 | 图6 不同反应温度下氧载体转化率随时间的变化Fig. 6 Changes of conversion ratio with time for oxygen carrier at different reaction temperatures(a) Reduction; (b) Oxidation |
4.2.4 材料表征
将粒径为125~200 μm的氧载体颗粒交替暴露于氮气气氛和空气气氛下进行循环特性研究。脱氧反应的温度为900 ℃, 氧化反应的温度为700 ℃, 气体流量为30 mL/min, 氧载体脱氧-吸氧循环反应的质量变化曲线如图7所示。氧载体循环4次后, 脱氧-吸氧反应逐渐趋于稳定, 随着循环次数增加, 氧载体达到完全氧化需要的时间基本相同, 而氧载体能否完全氧化对氧载体的活性影响较大, 表明氧载体在23次循环后仍保持了很高的活性。循环反应的氧传递量稳定为0.0599 mg/mg氧载体, 脱氧反应和氧化反应的时间均低于15 min, 则每吨该类型氧载体的氧气产量可达到83.95 Nm3/h。
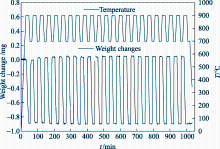 | 图7 氧载体脱氧-吸氧循环反应质量变化Fig. 7 Weight changes with oxidation-reduction cycle reaction for the oxygen carrier |
图8示出了新鲜和23次循环后氧载体的表面形貌,由图中可以看出, 所制备的氧载体为细小的CuO颗粒附着在大块的SiO2颗粒上, 大块SiO2颗粒作为载体可以提高氧载体的机械强度。新鲜氧载体表面由粒径1~10 μm的细微颗粒构成, 颗粒表面较为粗糙, 有较大的有效反应面积。循环反应后氧载体表面变得光滑, 细小致密的CuO晶粒长大并相互连接, 氧载体孔隙率变大, 颗粒呈现蜂窝状结构, 变得疏松多孔, 机械强度变差, 因此在工业应用时要选择合适的反应器类型。
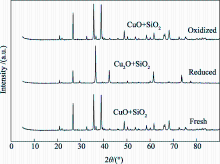
图9为新鲜氧载体及经23次循环后脱氧/氧化反应得到的样品的XRD图谱。由图9可知, 新鲜和吸氧后的氧载体主要成分为CuO和SiO2, 脱氧反应后的主要成分为Cu2O和SiO2, 没有形成Cu-Si的氧化物而影响CuO的脱氧性能[ 20, 21]。循环吸氧后氧载体中CuO的衍射主峰强度与新鲜样品相比基本相同, 即氧载体中CuO的含量基本保持不变, 证明了氧载体制备方法和循环性能的稳定性。
1) 在N2氛围中, 当反应温度高于850 ℃时, Cu/Si氧载体脱氧反应进入快速反应阶段, 氧载体在空气氛围中的再生反应的快速反应阶段的温度高于400 ℃;
2) 氧载体反应速率随颗粒直径减小及气体流量增大而增大, 但变化不明显; 而随着反应温度升高, 氧载体脱氧和吸氧反应速度都会急剧增大;
3) 23次循环实验中, 氧载体脱氧-吸氧稳定, 循环反应的氧传递量稳定为0.0599 mg/mg, 经循环之后的氧载体, 颗粒空隙增加且无烧结现象的发生, 物相分析结果表明氧载体脱氧后的成分主要有Cu2O和SiO2, 吸氧后的成分主要有CuO和SiO2, 氧载体的制备方法和循环性能有很好的稳定性和适应性。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|